-
Conceptos básicos sobre el vapor
-
Atributos del vapor
-
-
-
Diagrama de las fases de agua
La Figura 1.1 muestra una representación gráfica de las fases del agua bajo la presión atmosférica. Ilustra el contenido descrito en “Fases del agua”. El eje horizontal corresponde a la entalpía específica y el eje vertical, a la temperatura. El diagrama de las fases del agua muestra el cambio de temperatura y de fase en función de la entalpía específica contenida en las moléculas de agua.

Figura1.1 Diagrama de las fases del agua bajo la presión atmosférica
La figura anterior expresa los siguientes elementos, calor sensible (entalpía de la temperatura de saturación, h’) antes de que el agua se caliente de 0 a 100˚ C, la cantidad total de calor cuando la totalidad del agua saturada se convierte en vapor (entalpía h" de vapor saturado), y el calor latente necesario para la evaporación (entalpía de evaporación r = h” – h’). El vapor en el estado que el agua saturada se evapora se denomina vapor saturado húmedo mientras que una vez que todo el vapor se ha saturado se llama vapor saturado seco. A medida que el vapor saturado seco se calienta nuevamente, la temperatura sube. El vapor con una temperatura mucho más alta que la temperatura de saturación se denomina vapor sobrecalentado y la diferencia de temperatura entre el vapor sobrecalentado y el vapor saturado se llama vapor sobrecalentado.
De aquí en adelante, se hace referencia a la entalpía del agua como 'calor sensible#39;, la entalpía de la evaporación y el calor que posee el vapor como 'calor latente #39; y el calor del vapor como 'calor total#39;.
-
La energía del vapor
Tal como hemos mencionado anteriormente, el vapor cambia de fase y se convierte en condensado después de que se usa para calentar y pierde su calor latente. En ese punto, la temperatura es igual a la del vapor. El calor latente con esta propiedad es una energía extremadamente efectiva en procesos que requieren un tratamiento térmico estable a temperatura constante, esterilización, etc. La razón por la cual el vapor es excelente como portador de energía es que es una sustancia común que puede contener una cantidad muy grande de calor latente.
Se puede confirmar la cantidad de calor latente contenido en una tabla de vapor saturado. La Tabla 1.2 es un extracto de una tabla de vapor saturado. Por ejemplo, en el caso de la presión atmosférica (presión manométrica de 0,0 MPa), el contenido es el siguiente (redondeado el valor a un decimal).Calor sensible del agua saturada: h’=419 kJ/kg
Calor total del vapor: h”=2.676 kJ/kg
Calor latente: r=h”-h’=2.257 kJ/kgPor lo tanto,
la proporción del calor total del vapor) =2.257/2.676=0,8434 ≒ 84%
(La cantidad de calor latente que retiene el vapor en relación con el calor sensible) =2.257 / 419 = 5,3866 ≒ 5,39
De esta manera, el vapor a la presión atmosférica tiene un 84% del calor total como calor latente, o dicho de otra manera, su calor latente es 5,39 veces el calor sensible.
La Tabla 1.1 muestra una comparación de las propiedades termodinámicas del agua, el amoniaco, el metanol y el etanol. Comparativamente, se puede ver que el agua tiene una alta proporción de calor latente.
Tabla 1.1 Propiedades termodinámicas de sustancias comunes a la presión atmosférica
Sustancia
Punto de fusión (℃)
Punto de ebullición (℃)
Calor de fusión (kJ/kg)
Calor latente (kJ/kg)
Agua
0
100
333.5
2,257
Amoniaco
-77.8
-33.4
338
1,371
Metanol
-97.7
64.7
99.2
1,190
Etanol
-114.1
78.6
109
855
A medida que aumenta la presión, se necesita más potencia calorífica para alcanzar la saturación, y la temperatura también aumenta sin que se produzca un cambio de fase. En otras palabras, tanto el calor sensible como la temperatura de saturación aumentan. La Figura 1.2 muestra esta relación como una curva de presión de vapor saturado. En esta curva, tanto el agua como el vapor pueden coexistir a la misma temperatura de saturación. Por debajo de la curva está el agua que aún no ha alcanzado la temperatura de saturación, y por arriba de la curva está el vapor sobrecalentado.

Figura 1.2 Curva de presión de vapor saturado
¿Cómo cambia la capacidad calorífica del vapor saturado y del agua saturada con el aumento de la presión? La Figura 1.3 es un diagrama que muestra esas relaciones. El gráfico muestra los siguientes hechos.
1. El calor sensible del agua saturada aumenta con la presión del agua.
2. El calor latente del vapor disminuye a medida que aumenta la presión.
El calor de vapor total (la suma de "1. calor sensible" y "2. calor latente") es casi constante en comparación con sus componentes, aunque aumenta levemente en el intervalo de la baja presión. (Sin embargo, disminuye a la inversa de alrededor de los 3,2 MPa, y el calor latente se vuelve cero cuando se alcanza el punto crítico).
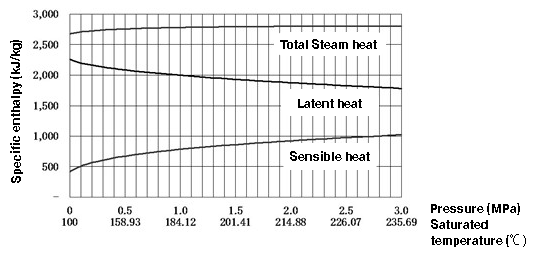
Figura 1.3 Relación entre cantidad de calor y presión para el vapor y el agua saturada
Lo que debe mencionarse en este punto es que el calor latente necesario para la evaporación disminuye al aumentar la presión. Esto significa que cuanto más alta es la presión de vapor, menor es la cantidad de calor latente disponible. Por ejemplo, como se muestra en la Tabla 1.2 de vapor saturado, el calor latente de 0,5 MPa y 1,0 MPa, r es 2.085 kJ/kg y 1.998 kJ/kg respectivamente. Por lo tanto, el calor latente a 1,0 MPa es menor que el calor latente a 0,5 MPa y ambos son menores que 2.257 kJ/kg, el calor latente a la presión atmosférica (0,0 MPa).
A continuación, la Figura 1.4 muestra las relaciones entre el volumen específico y la presión del vapor. Como muestra la figura, el volumen específico es inversamente proporcional, varía mucho en el intervalo de baja presión y disminuye a medida que aumenta la presión. Cuanto mayor es la presión, menor es el calor latente por unidad de masa (1 kg), y también menor es su volumen, lo que resulta en un aumento del calor latente por unidad de volumen (1 m3). Por lo tanto, al aumentar la presión del vapor, es posible transportar más energía en una línea principal de vapor de tamaño relativamente pequeño. Éste es uno de los puntos más importantes que se deben considerar en el diseño de los sistemas de tuberías de vapor.

Figura 1.4 Relación entre la presión del vapor y el volumen específico
Tabla 1.2 Tabla de vapor saturado (base de presión manométrica)
Presión manométrica (MPa)
Temperatura de saturación (°C)
Volumen específico (m3/kg)
Relación masa/volumen (kg/m3)
Calor latente (kJ/kg)
Agua saturada
Vapor saturado
Calor sensible
Total
Calor latente
v’
v”
h’
h”
r=h”-h’
0.0
100.00
0.0010437
1.67300
0.5977
419.06
2676.0
2256.9
0.1
120.44
0.0010610
0.87999
1.1364
505.58
2706.6
2201.0
0.5
158.93
0.0011096
0.31482
3.1764
670.79
2755.6
2084.7
1.0
184.12
0.0011331
0.17718
5.6440
781.36
2779.7
1998.3
-
Fracción de sequedad
El vapor se genera en una caldera industrial y luego se transporta al lugar donde es utilizado. Producir vapor 100 % seco en la caldera industrial es prácticamente imposible, el vapor industrial contiene siempre unas pocas gotas de agua. El vapor que contiene agua líquida se llama vapor húmedo. Sin embargo, en la mayoría de las aplicaciones de vapor se necesita vapor seco al 100 %. La parte del vapor húmedo que en realidad es vapor en lugar de agua se llama "porcentaje de vapor seco"; o simplemente "vapor seco". Cuanto mayor sea el porcentaje de vapor seco, mayor será la calidad del vapor.
El porcentaje de vapor seco (χ) es la relación de masa entre el vapor seco y la masa total del vapor húmedo. Por ejemplo, el porcentaje de vapor seco es 0,95 cuando el vapor contiene un 5% de agua. Además, (1-χ) se denomina porcentaje de vapor húmedo. El porcentaje de vapor seco del vapor de una salida de caldera típica suele ser de 0,95 a 0,98. La cantidad de calor (entalpía específica, h) que tiene el vapor húmedo saturado se describe mediante la siguiente fórmula con los símbolos de la Figura 1.1.
h=(1-χ)h’+χh”=h’+χr
-
Vapor flash
El término "vapor flash" se utiliza generalmente para describir el vapor que proviene de la ventilación del receptor de condensado y las líneas abiertas de descarga de condensado después de las trampas de vapor. ¿Por qué se forma vapor sin agregar calor? El vapor flash se produce cuando el agua con una temperatura comparativamente alta se despresuriza tanto que la temperatura de saturación a la nueva presión del agua es inferior a la temperatura del agua original.
Tan pronto como la temperatura de saturación del agua desciende por debajo de su temperatura real, parte del agua comienza a evaporarse. A continuación, se muestra el ejemplo de condensado que pasa por una trampa de vapor. La temperatura del lado primario es casi siempre lo suficientemente alta como para permitir que se produzca vapor flash.

Figura 1.5 Formación de vapor flash
En la Figura 1.5, la presión del lado primario de la trampa de vapor es 0,5 MPa (es decir, una temperatura de saturación de aproximadamente 159° C, temperatura del agua supuesta para el ejemplo) y el condensado (se supone que sea de 1 kg para facilitar el siguiente cálculo) se descarga a una línea de condensado que está abierta a la atmósfera.
Tal como se muestra en la Tabla 1.2, el calor sensible para 1 kg de condensado a 0,5 MPa y a la temperatura de saturación es de 671 kJ. De la primera ley de la termodinámica se desprende que la capacidad calorífica total del fluido es igual entre los lados de alta y baja presión de la trampa de vapor, lo que generalmente sigue la ley de conservación de la energía (pérdida de calor por la disipación del mismo y la resistencia al flujo en la trampa de vapor puede descartarse). Por lo tanto, 1 kg de agua que fluye hacia el lado de baja presión tendrá una capacidad calorífica de 671 kJ. Sin embargo, el agua a 0 MPa a la temperatura de saturación (100°C) solo tiene un calor sensible de 419 kJ, es decir, que hay un desequilibrio de 671 - 419 = 252 kJ. Desde la perspectiva del agua, este es un exceso de calor, pero ese exceso de calor se convierte en calor latente: hierve parte del condensado y lo convierte en vapor. Ese vapor se llama vapor flash y el proceso se llama flash.
Por lo tanto, 1 kg de condensado, que existe como líquido en el lado de alta presión de la trampa, existirá en parte como líquido y en parte como vapor en el lado de baja presión.
La cantidad de vapor flash que se forma se puede calcular con la siguiente fórmula.
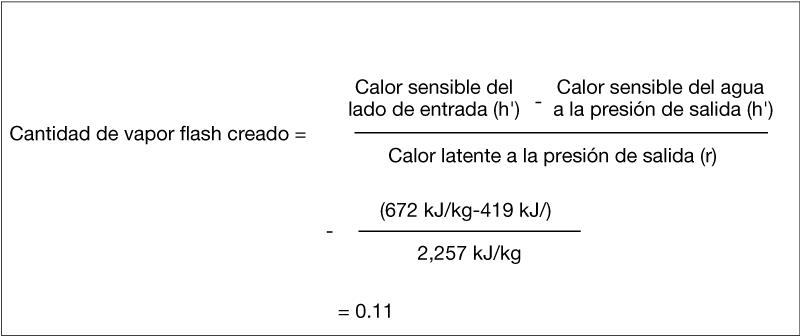
Por lo tanto, la cantidad de vapor flash que se forma por 1 kg de condensado es de 0,11 kg.
La fracción de vapor flash generada por la despresurización es la relación entre el exceso de calor y el calor latente a la presión final.
Es importante señalar que el vapor flash no es solo un fenómeno que se produce naturalmente en el sistema de vapor, sino también un efecto que se aprovecha y calcula deliberadamente para maximizar la eficacia del uso del vapor. El equipo típico para crear vapor flash es un tanque flash.
-
Otras propiedades
Como se ha descrito anteriormente, la razón por la que el vapor es tan utilizado como portador de energía es que su cantidad relativa de calor latente es grande y el agua además de ser abundante en la tierra, es económica. También se pueden mencionar los siguientes puntos.
- Es ambientalmente benigno para los humanos.
- Es un producto químico estable, no corrosivo y no inflamable.
- Proporciona un calentamiento uniforme en comparación con otros medios de fuente de calor.
- La temperatura de saturación se puede controlar cambiando la presión de funcionamiento. Por lo tanto, la temperatura de calentamiento necesaria se puede obtener ajustando la presión.
- Dado que la diferencia de volumen específico entre el vapor y el condensado es grande, se suministra nuevo vapor tan pronto como se condensa el vapor.
Las siguientes son las desventajas del uso de vapor.
- A menos que se diseñe y mantenga un sistema de vapor con el objetivo específico de mantenerlo libre de aire (hecho que significa un gran esfuerzo), la mezcla de aire y (si correspondiese) de otros gases con el vapor es inevitable. Tal mezcla reduce significativamente la eficacia de transferencia de calor.
- El agua utilizada para la generación de vapor nunca es pura. Siempre contiene impurezas que pueden causar varios problemas en la generación o en la calidad del vapor. Dado que el agua sin procesar utilizada para generar vapor no es agua pura, las impurezas que causan oxidación y corrosión están disueltas en ella y no pueden eliminarse por completo en el proceso de generación de vapor.
-
Puede ser necesario tomar medidas anticongelantes según la ubicación de la trampa de vapor, ya que el punto de congelación del agua es de 0 °C.